转载自:中国食品药品网
中国食品药品网讯 国家药监局出台《支持福建探索海峡两岸融合发展新路 推动药品医疗器械化妆品监管创新发展工作方案》;国家药监局药品审评检查长三角分中心、大湾区分中心增设对外受理服务窗口……11月29日—12月5日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局出台《支持福建探索海峡两岸融合发展新路 推动药品医疗器械化妆品监管创新发展工作方案》,支持福建在药品监管领域先行先试,助力福建建设两岸融合发展示范区和台胞台企登陆第一家园。该方案聚焦药品、医疗器械、化妆品监管创新,提出7项重点任务,包括支持福建省内的台资药品上市许可持有人和医疗器械注册人发展、支持福建省内的台资化妆品注册人发展、支持福建开展进口第一类医疗器械备案、支持台湾地区进口医疗器械注册人在福建省内开展境内第三类医疗器械注册申报、支持福建在探索两岸中药传承创新融合发展上先行先试、支持福建开展两岸药品监管科学研究、支持福建持续加强两岸医药民间交流。
2.国家药监局药品审评中心(CDE)发布《新药临床安全性评价技术指导原则》。该指导原则针对新药上市前两个阶段安全性评价的不同侧重点,分别阐述相应的安全性评价内容和分析评估方法,适用于化学药品和治疗用生物制品新药的临床安全性评价。
3.CDE发布《氟[18F]脱氧葡糖注射液仿制药药学研究技术要求(试行)》。该技术要求根据氟[18F]脱氧葡糖注射液特点,提出氟[18F]脱氧葡糖注射液仿制药药学研究技术要求和申报资料要求,为该品种仿制药的研发提供技术指导。
4.CDE发布《特应性皮炎治疗药物临床试验技术指导原则》。该指导原则旨在为特应性皮炎治疗药物临床试验设计提供技术指导,适用于化学药品及治疗用生物制品的临床研发。根据特应性皮炎发病年龄低的特点,该指导原则还对儿科特应性皮炎临床试验进行了重点阐述。
5.CDE《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则(征求意见稿)》公开征求意见。征求意见稿内容主要包括概述、早期临床试验、确证性临床试验、安全性评价、临床病毒学注意事项和附录。征求意见时限为自发布之日起1个月。
6.CDE发布通知,自2023年12月1日起在国家药品监管局药品审评检查长三角分中心、大湾区分中心增设对外受理服务窗口。其中,长三角分中心向长三角区域内(上海市、江苏省、浙江省和安徽省)药品注册申请人提供受理服务;大湾区分中心向大湾区区域内(香港特别行政区、澳门特别行政区、广州市、深圳市、珠海市、佛山市、惠州市、东莞市、中山市、江门市、肇庆市)药品注册申请人提供受理服务。申报资料递交方式及地点不变,仍由国家药监局药审中心统一接收。
7.CDE网站公示19个仿制药一致性评价任务,涉及注射用头孢唑肟钠等品种(截至12月5日)。
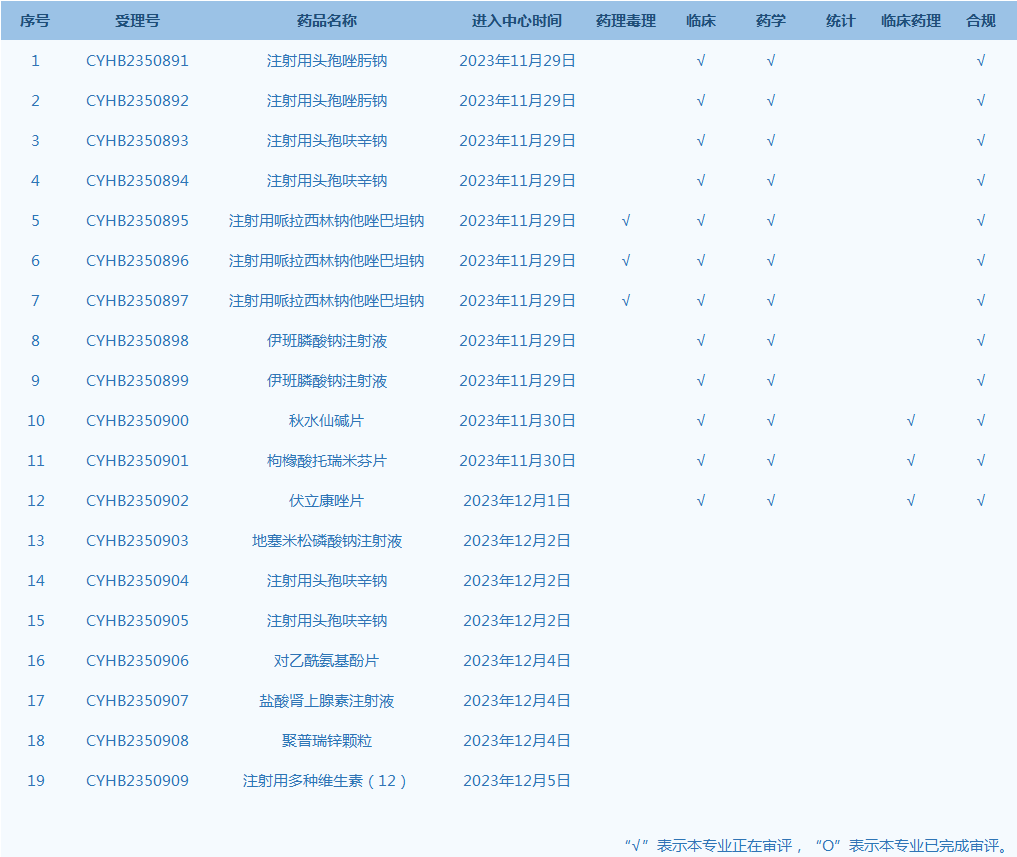
产品研发上市信息
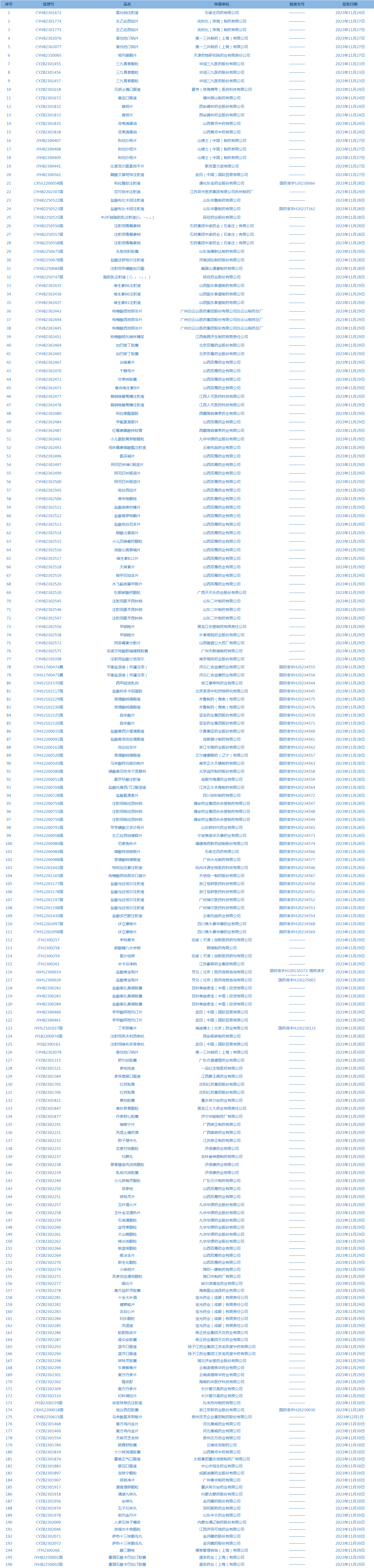
1.国家药监局发布4期药品批准证明文件送达信息,共包括196个受理号,涉及石家庄四药有限公司等企业(截至12月5日)。
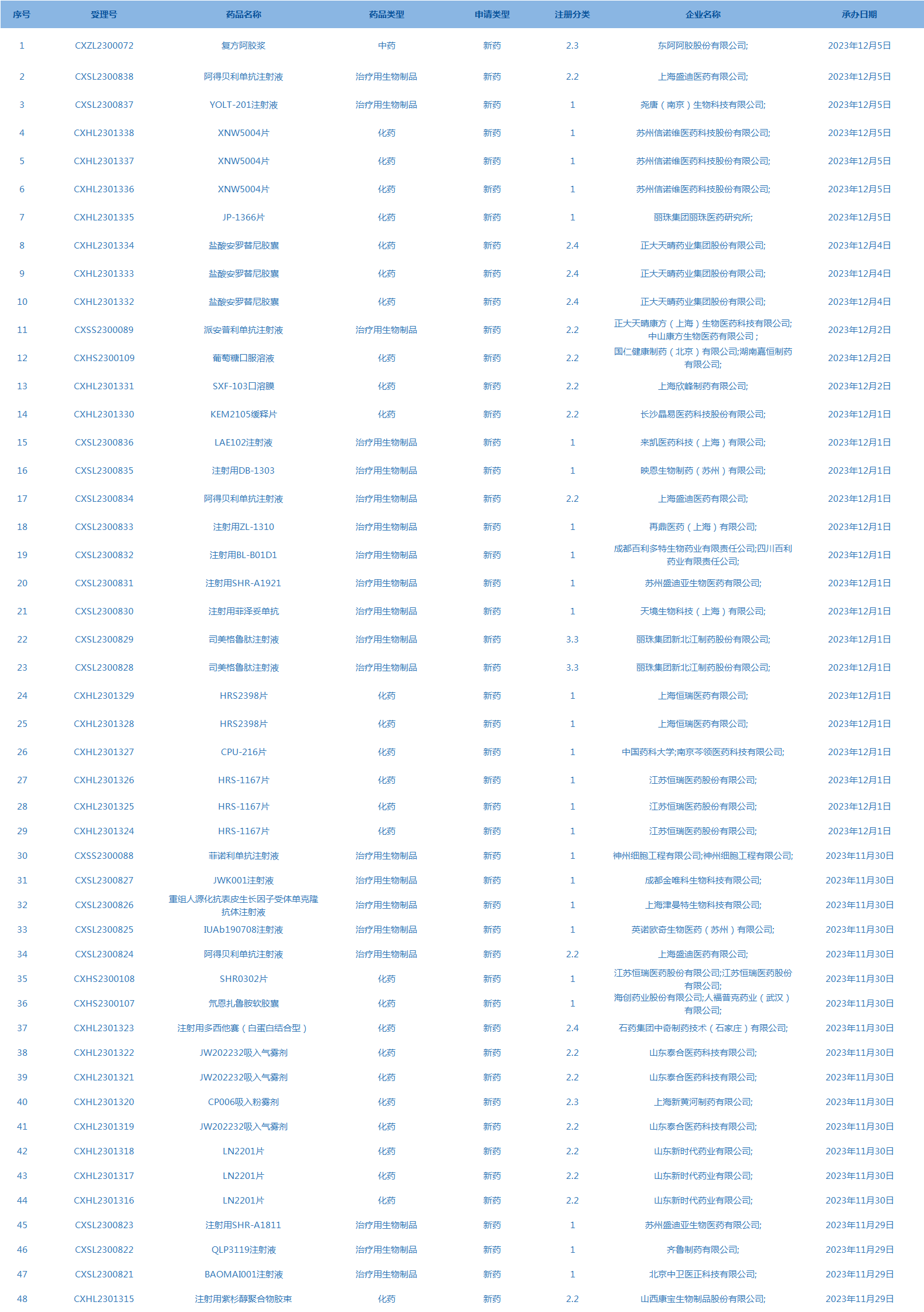
2.CDE承办受理48个新药上市申请,包括YOLT-201注射液等药品(截至12月5日)。
3.君实生物发布公告称,公司产品特瑞普利单抗(产品代号:TAB001/JS001)联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请已获得澳大利亚药品管理局(TGA)受理。
4.科济药业宣布,美国食品药品管理局(FDA)已批准公司产品CT071的IND申请。CT071是一种靶向G蛋白偶联受体C组5成员D(GPRC5D)的自体CAR-T细胞候选产品,用于治疗复发/难治多发性骨髓瘤或复发/难治原发性浆细胞白血病患者。
5.士泽生物宣布,其首个研发管线——临床级iPSC衍生亚型神经前体细胞产品获得美国FDA授予孤儿药资格,拟用于治疗“渐冻症”(肌萎缩侧索硬化症,ALS)。
医药企业观察
1.辰欣药业发布公告称,决定终止控股子公司佛都药业分拆上市事项。终止分拆上市后,佛都药业拟申请在新三板挂牌,未来根据资本市场环境及战略发展需要,择机寻求在北京证券交易所上市。
2.圣因生物宣布完成超8000万美元(近6亿元人民币)的A+轮融资,本轮融资由腾讯投资、元生创投领投,北极光创投、建发新兴投资、元禾控股等机构跟投,老股东启明创投、雅惠投资、险峰旗云等持续加持。本次募集资金将主要用于加速公司针对心血管及代谢性疾病、免疫介导性疾病等药物管线的IND申报和临床试验,以及推进肝外递送平台的建设和药物开发。
3.医诺康宣布完成近亿元人民币Pre-A轮融资。本轮融资由华金投资领投,乾道基金、海南隆门基金、中金策投资跟投,原股东聚明创投追投增持。浩悦资本担任本轮融资的独家财务顾问。该公司正在推进分子胶、蛋白降解靶向嵌合体等研发管线布局,将开展两项IND enabling阶段的管线研发。
药品集中采购
1.江苏省医保局发布《关于征求省第二轮药品集中带量采购续约供应意向的通知》,决定将未纳入国家集采范围的省第二轮集采品种采购周期延长1年,现征求相关企业供应意向。通知显示,对达肝素钠注射剂、葛根素注射剂、头孢唑肟注射剂3个品种,原中选企业愿意按不高于该产品全国省级及省际联盟带量采购最低中选(备选)价格(含已公示未公布价)继续供应江苏省的,暂予以续签1年。
2.湖南省医保局发布《关于做好陕西九省联盟药品接续采购品种数据填报工作的通知》,全省各级公立医疗机构(含军队医疗机构)均应参与数据填报,鼓励其他社会办医保协议医药机构参加。本次联盟采购按照企业品牌和规格报量,医药机构按照企业产品填报2022年历史采购量和未来一年的采购需求量(单位:片/粒/支/袋),原则上不低于同通用名下历史采购总量的80%,未达到的,须在系统中说明理由;完成历史采购量和采购需求量填报工作后,需上传经本单位主要负责人签字并加盖公章的承诺函。
Copyright © 2011-2012 350浦京首页集团 All Rights Reserved. 粤ICP备2022155250号-1
电
话:0755-82497618 传 真:0755-82497861