转载自:中国医药报
中国食品药品网讯 《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》发布;固精养元合剂由处方药转换为非处方药……12月13日—12月19日,医药行业的这些动态值得关注。
行业政策动态
1.国家医保局、人力资源社会保障部印发《国家基本医疗保险、工伤保险和生育保险药品目录(2023年)》,自2024年1月1日起正式执行。本次共有126个药品新增进入国家医保药品目录,1个药品被调出目录。143个目录外药品参加谈判或竞价,其中121个药品谈判或竞价成功,谈判成功率为84.6%,平均降价61.7%。本轮调整后,国家医保药品目录内药品总数达到3088种,其中西药1698种、中成药1390种;中药饮片仍为892种。
2.国家药监局发布公告,决定适用《Q13:原料药和制剂的连续制造》国际人用药品注册技术协调会指导原则(以下简称《Q13指导原则》)。申请人需在现行药学研究技术要求基础上,按照《Q13指导原则》的要求开展研究;自2024年6月13日开始的相关研究(以试验记录时间点为准),均适用《Q13指导原则》。
3.国家药监局发布公告,固精养元合剂由处方药转换为非处方药。品种名单及非处方药说明书范本一并发布。
4.国家药监局发布公告,决定对清火片和清火胶囊说明书中的警示语及【不良反应】【禁忌】和【注意事项】项进行统一修订。
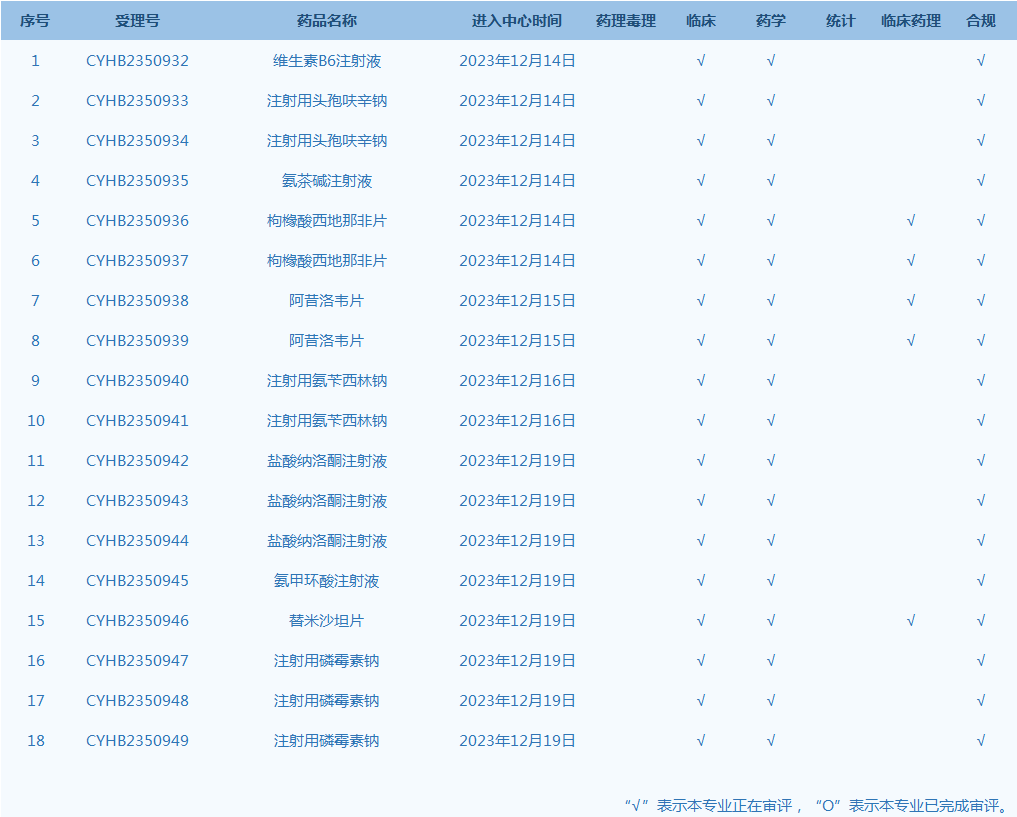
5.国家药监局药品审评中心(CDE)网站公示18个仿制药一致性评价任务,涉及维生素B6注射液等品种(截至12月19日)。
产品研发上市信息
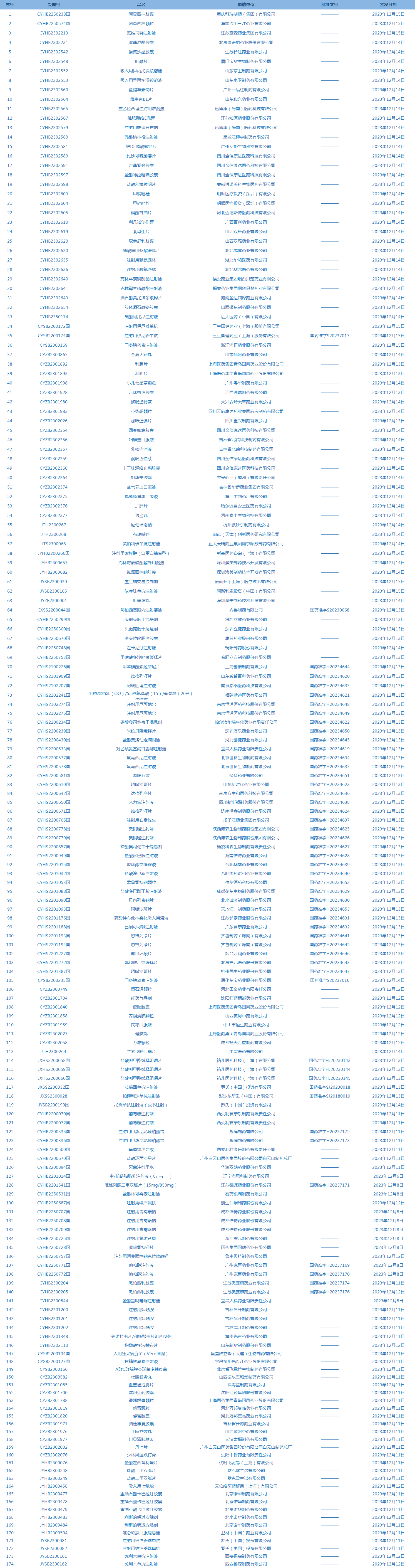
1.国家药监局发布3期药品批准证明文件送达信息,共包括174个受理号,涉及西安杨森制药有限公司等企业(截至12月19日)。
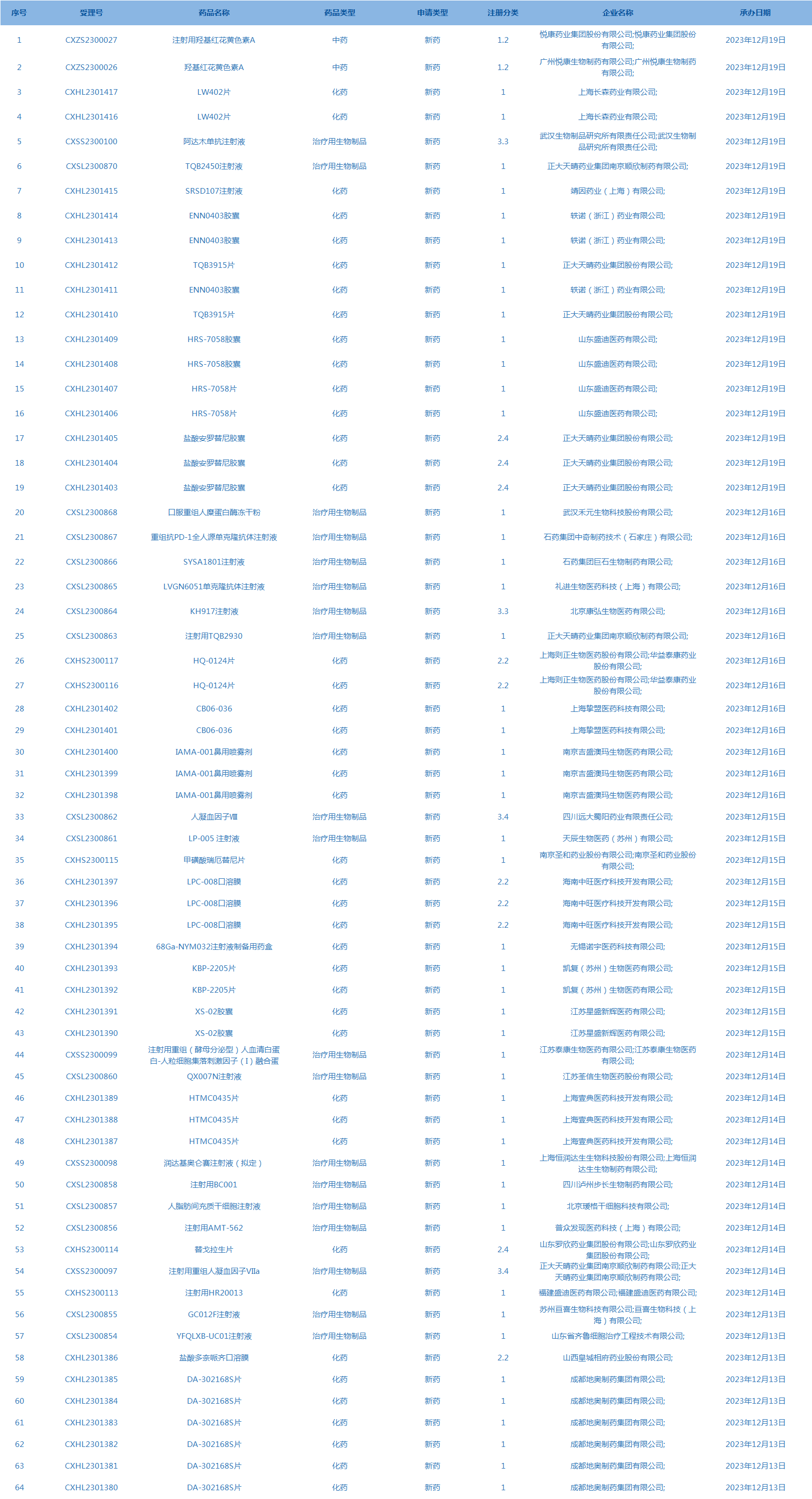
2.CDE承办受理64个新药上市申请,包括LW402片等药品(截至12月19日)。
3.华海药业发布公告称,公司向美国食品药品管理局(FDA)申报的注射用培美曲塞二钠的新药简略申请(ANDA)已获得批准。
4.和誉医药宣布,其创新CSF-1R抑制剂pimicotinib(ABSK021)获美国FDA授予快速通道资格,用于治疗不可手术的腱鞘巨细胞瘤(TGCT)。
5.诺泰生物发布公告称,收到美国FDA签发的司美格鲁肽原料药DMF First Adequate Letter,表明公司的司美格鲁肽原料药已通过技术审评,其质量已获得FDA的认可,可满足当前关联制剂客户的ANDA申报要求。
医药企业观察
1.和铂医药发布公告称,公司全资子公司诺纳生物与Seagen Inc.已就HBM9033(间皮素抗体偶联药物)的全球临床开发及商业化订立许可协议。根据协议,诺纳生物将收取总额为5300万美元的预付款及近期付款;基于若干待达成的开发及商业化成果计算的潜在里程碑付款,总额可高达约10.5亿美元;以及按净销售额支付的分级特许权使用费,最高比例可达高双位数。
2.楷拓生物与科镁信在苏州举办战略签约仪式,双方将在全球范围内开展脂质纳米颗粒(Lipid Nanoparticle)递送mRNA等核酸药物的技术合作,加快核酸药物临床及商业化应用的步伐。
3.西比曼生物宣布与强生旗下杨森制药签署的全球合作和许可协议进行修订,根据修订后的协议,对于靶向CD20的嵌合抗原受体T(CAR-T)细胞C-CAR039和C-CAR066产品,杨森制药将拥有在中国对其进行商业化的权利。在实现商业化后,西比曼生物将获得里程碑付款。目前,西比曼生物正在开展C-CAR039和C-CAR066治疗非霍奇金淋巴瘤(NHL)的临床研究。
4.血霁生物宣布完成A1轮融资首关,二关同时启动,预计三个月后结束。本轮融资由中博聚力和国信创新股权共同领投,苏州工业园区科创基金和青创基金投资,以及老股东鼎晖投资继续增资。本轮融资主要用于推动血霁生物三个血小板相关管线的新药临床试验申请(IND),支持临床前研究的多个环节工作的完成,以及血小板药物递送、血小板裂解液等多板块产业化推进。
药品集中采购
1.江西省医保局公示干扰素省际联盟集中带量采购拟中选结果,公示时间为2023年12月15日—21日。此次集采共有14个品种拟中选,剂型包括注射剂、阴道泡腾片、软膏、栓剂、凝胶剂、喷雾剂及滴眼剂。
2.广东省药品交易中心发布《关于开展广东省第三方药品电子交易平台药品挂网采购报名工作的通知》。通知明确,企业新增报名药品中属于麻醉药品和第一类精神药品的,其中有政府指导价的药品按国家和省有关规定确定价格后直接挂网,无政府指导价的药品按企业申报价格并参照药品差比价规则就低差比计算价格后直接挂网;属于短缺药品的(指国家和广东省短缺药品清单所列品种),按企业申报价格并参照药品差比价规则就低差比计算价格后直接挂网。
Copyright © 2011-2012 350浦京首页集团 All Rights Reserved. 粤ICP备2022155250号-1
电
话:0755-82497618 传 真:0755-82497861