转载自:中国食品药品网
中国食品药品网讯 国家药监局发布新修订《药品召回管理办法》;多潘立酮制剂、注射用黄芪多糖和板蓝根注射液等说明书修订……10月26日—11月1日,医药行业的这些动态值得关注。
行业政策动态
1.市场监管总局等七部门联合印发《关于进一步规范明星广告代言活动的指导意见》。《指导意见》规定,明星不得为医疗、药品、医疗器械、保健食品和特殊医学用途配方食品进行广告代言,从事医疗、药品、医疗器械、保健食品等行业的企业不得利用广告代言人进行广告宣传。《指导意见》自公布之日(10月31日)起实施。
2.国家卫生健康委联合国家药监局、国家医保局等13个部门,印发《遏制微生物耐药国家行动计划(2022-2025年)》。《行动计划》部署了9项指标、8项主要任务,包括研发上市全新抗微生物药物1-3个,研发新型微生物诊断仪器设备和试剂5-10项;对于耐药感染预防、诊断和治疗相关临床急需的新药、疫苗、创新医疗器械等,依程序优先审评审批;科学开展抗微生物药物的医保谈判、国家组织药品集中采购和医保支付方式改革工作等。
3.国家药监局发布新修订《药品召回管理办法》,自2022年11月1日起施行。新版《办法》包括总则、调查与评估、主动召回、责令召回、附则等五章共33条。明确持有人是控制风险和消除隐患的责任主体,药品生产企业、药品经营企业、药品使用单位应当积极协助,对于中药饮片、中药配方颗粒的召回,其生产企业按照新版《办法》组织实施。新版《办法》完善了持有人对可能存在质量问题或者其他安全隐患药品的调查评估要求,细化了持有人主动召回实施程序,督促和指导持有人对存在质量问题或者其他安全隐患药品及时主动召回,切实履行药品全生命周期管理义务。
4.国家药监局发布公告,自2022年12月1日起,对签发的《出口欧盟原料药证明文件》和《药品出口销售证明》启用电子证明。电子证明与纸质证明具有同等效力。
5.国家药监局发布公告,决定对多潘立酮制剂(包括多潘立酮片、多潘立酮分散片、多潘立酮口腔崩解片、多潘立酮胶囊、多潘立酮混悬液、马来酸多潘立酮片)说明书内容进行统一修订;对注射用黄芪多糖、灯盏花素氯化钠注射液和板蓝根注射液说明书中的警示语及【不良反应】【禁忌】和【注意事项】项进行统一修订。
6.国家药监局综合司发布《关于国家药监局批准药品电子注册证统一使用“国家药品监督管理局药品注册专用章”电子印章有关事宜的通知》。自2022年11月1日起,国家药监局批准的药品电子注册证统一使用“国家药品监督管理局药品注册专用章”电子印章。其中,“药物非临床研究质量管理规范认证证书”“进口药材批件”“进口药材补充批件”以及港澳已上市传统外用中成药的境内注册事项的“药品注册证书”“药品补充申请批准通知书”“药品再注册批准通知书”所用印章由原印章调整为“国家药品监督管理局药品注册专用章”电子印章。
7.国家药监局药品审评中心(CDE)就《药物临床试验方案审评工作规范(征求意见稿)》公开征求意见。工作规范适用于临床试验申请、补充申请和沟通交流申请中涉及临床试验方案的资料提交与审评,尤其是针对确证性(或关键性)临床试验方案,旨在提高申请人撰写临床试验方案的质量、规范针对临床试验方案的沟通交流和各类注册申请,提高临床试验方案的审评质量。征求意见截止日期为2022年11月26日。
8.CDE就《人乳头瘤病毒疫苗临床试验技术指导原则(征求意见稿)》公开征求意见。指导原则适用于拟在中国上市注册、以HPV主要衣壳蛋白L1组装为病毒样颗粒(VLP)的预防用疫苗,不适用于治疗性HPV疫苗,其他类型的预防用HPV疫苗(如以次要衣壳蛋白L2为靶点的预防用疫苗、嵌合VLP疫苗等)可参考执行。征求意见截止日期为2022年11月25日。
9.CDE公示化学仿制药参比制剂目录(第六十四批),涉及阿贝西利片等药品。公示期限为2022年10月29日—11月11日。
10.CDE网站公示10个仿制药一致性评价任务,涉及硫酸阿托品注射液等药品。(截至11月1日)
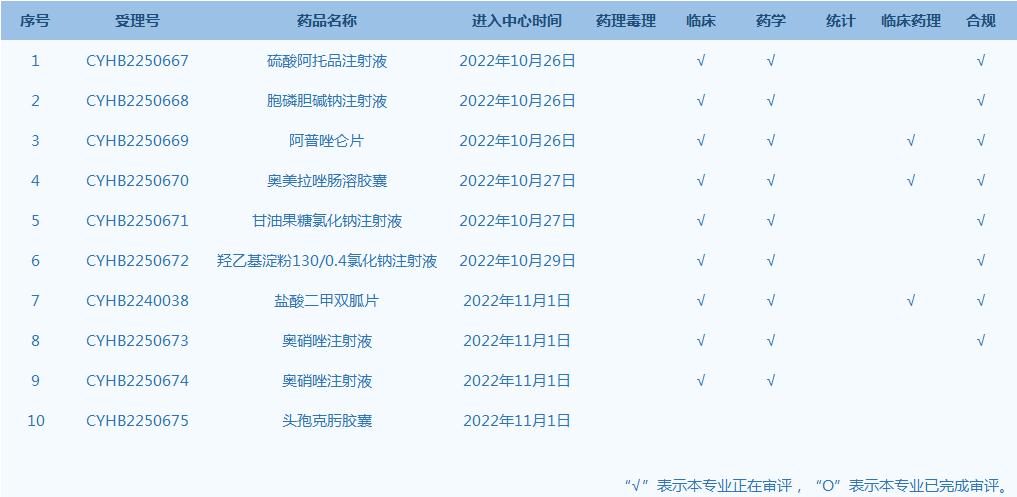
产品研发上市信息
1.国家药监局组织对GlaxoSmithKline(Ireland)Limited开展药品境外非现场检查,检查品种为度他雄胺软胶囊(英文名称:Dutasteride Soft Capsules;注册证号:H20160515;生产地址:Ul.Grunwaldzka 189,60-322 Poznan,Poland)。检查发现,该企业对出口中国的产品未按照注册标准进行逐批、全项检验,且在微生物污染风险防控方面存在不足,综合评定结论为该品种的生产质量管理不符合我国《药品生产质量管理规范》(2010年修订)要求。根据《中华人民共和国药品管理法》有关规定,国家药监局决定,自即日起暂停进口、销售、使用GlaxoSmithKline(Ireland)Limited度他雄胺软胶囊。各药品进口口岸药品监督管理部门暂停发放上述产品的进口通关单。
2.国家药监局发布3期药品批准证明文件待领信息,共包括173个受理号,涉及上海恒瑞医药有限公司等企业。(截至11月1日)

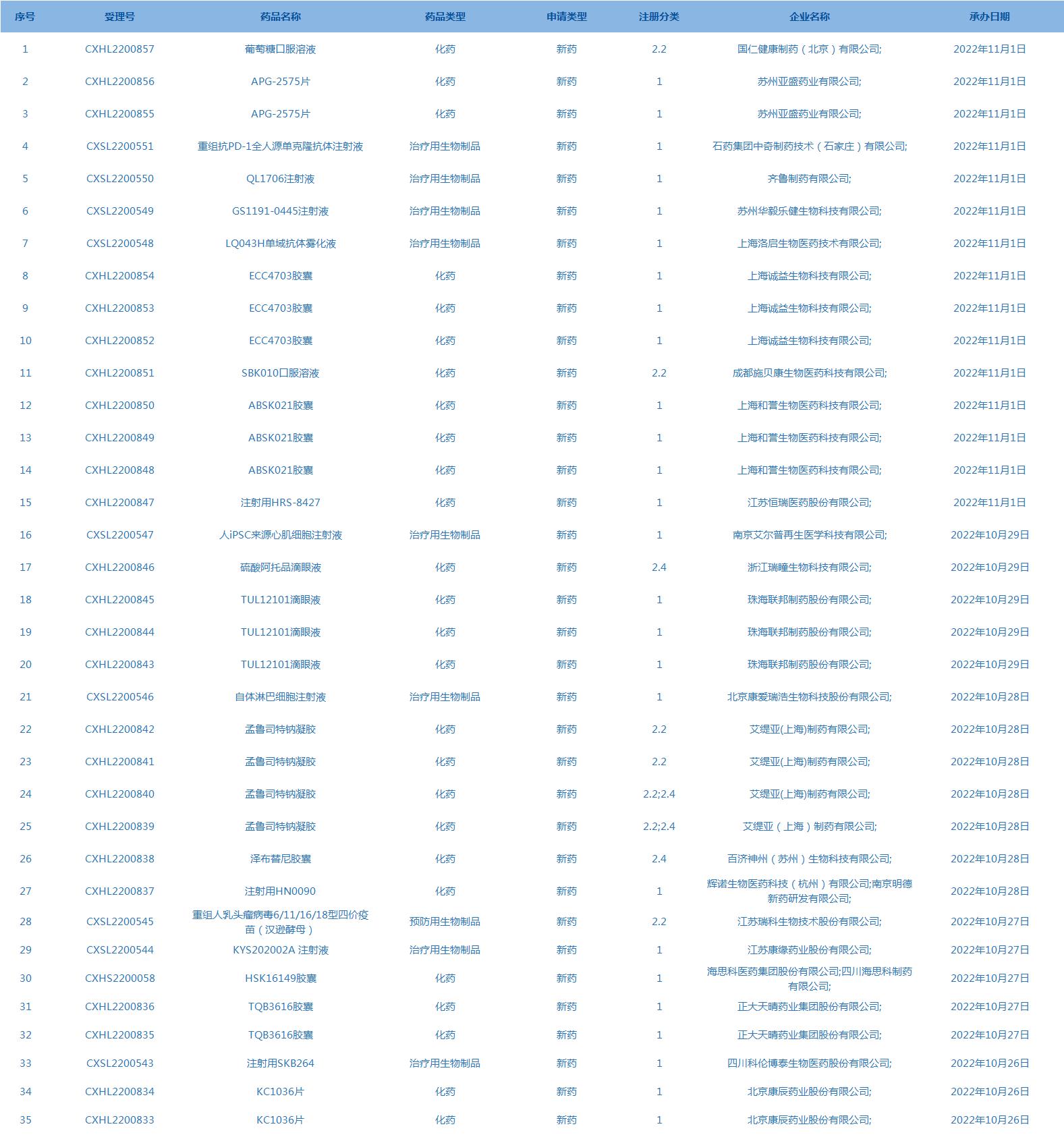
3.CDE承办受理35个新药上市申请,包括APG-2575片等药品。(截至11月1日)
4.众生药业发布公告称,收到韩国知识产权局颁发的专利证书。专利名称为一种作为FGFR4抑制剂化合物的盐型、晶型及其制备方法。
5.圣诺生物发布公告称,其全资子公司成都圣诺于近日获得欧洲药品质量管理局签发的醋酸奥曲肽原料药欧洲药典适用性认证证书。
6.和誉医药宣布,其在研新一代抗FGFR耐药突变抑制剂ABSK121临床试验获得美国食品药品管理局(FDA)临床研究许可,即将开展针对晚期实体瘤的国际首次人体Ⅰ期临床试验。
7.德琪医药宣布,其开发的ERK1/2小分子抑制剂ATG-017的1期临床试验申请(IND)已获美国FDA批准。德琪医药将在美国启动1期ERASER研究的联合治疗部分,以评估ATG-017联合PD-1抑制剂纳武利尤单抗用于治疗晚期实体瘤的安全性、药代动力学和初步疗效。
8.远大医药宣布,其放射性核素偶联药物(RDC)领域用于治疗胃肠胰腺神经内分泌瘤的创新药物ITM-11获得美国FDA授予快速通道资格。
医药企业观察
1.勤浩医药与药明康德在上海签署战略合作协议,共同宣布在创新药研发领域开展战略合作。
2.药明巨诺与美国2seventy bio公司宣布达成战略合作,双方将建立细胞治疗的转化及临床开发平台,在中国内地、中国香港和中国澳门地区加速T细胞免疫治疗产品的开发。双方的首要合作将围绕2seventy bio公司的MAGE-A4 TCR项目,拟开发用于治疗实体肿瘤。
3.博济医药发布公告,公司全资子公司博济投资作为有限合伙人参与投资东莞松山湖博创生技创业投资合伙企业(有限合伙),该合伙企业总规模为人民币5000万元,博济投资以自有资金出资1200万元,占总出资额的24.00%。
4.津药药业发布公告,公司子公司湖北天药委托天津药业研究院股份有限公司开展Y15、Y16、Y17项目的一致性评价工作,双方签署《技术开发(委托)合同》,金额分别为280万元、290万元、260万元,共计830万元。
5.华森制药发布公告,拟以自有资金出资不超过人民币1亿元设立全资子公司北京华森英诺生物科技有限公司(暂定名,以最终注册为准),全面承接公司创新药事业部业务。
6.方盛制药发布公告,公司控股子公司星辰创投基金决定对公司控股子公司广东融华进行增资扩股,公司及其另一股东放弃了同比例增资扩股权,公司所持股份数未发生变动,但持股比例降至65%。
7.新天药业发布公告,拟以自有资金3000万元人民币对参股公司上海汇伦医药进行增资。同时参与本次增资的还有其他市场投资者,本次增资合计1.02亿元。
8.双鹭药业发布公告称,拟以1084.92万元受让关联方新乡化纤持有的新乡双鹭药业的30%股权。受让完成后,新乡双鹭成为双鹭药业的全资子公司。
9.可瑞生物宣布完成亿元级Pre-A+轮融资,本轮融资由阳光融汇、馨瑞医疗共同领投,隆门资本跟投。本轮融资资金将用于多个创新的TCR-T细胞治疗产品与可溶性TCR蛋白药研发管线的推进,包括靶向KRAS G12突变的细胞治疗产品和靶向KRAS G12突变的TCR蛋白药物。
药品集中采购
1.河北省医保局发布《河北省化学药品、生物制剂集中带量采购文件(HBYPJC-2022-01)》,将对51个药品进行集采,采购周期为2年,约定采购量不少于上一年度医疗机构实际使用量的60%,不区分质量层次,但允许原研过评等高质量层次的药品自愿参与集采。首年约定采购量11月10日公布。
2.浙江省医保局发布《关于执行第七批国家组织药品集中采购中选结果的公告》,明确2022年11月10日开始执行第七批国采中选结果。实施机构范围包括全省所有公立医疗机构、军队医疗机构;自愿参与的医保定点社会办医疗机构和医保定点零售药店。采购周期执行《全国药品集中采购文件(GY-YD2022-1)》统一确定的采购周期。采购协议一年一签。
3.广东省医保局发布《关于做好第七批国家组织药品集中采购和使用工作的通知》,明确第七批国采首年采购周期为2022年11月30日至2023年11月29日。采购周期内购销协议每年一签。续签购销协议时,原则上不少于该中选产品上年度协议采购量。采购周期内,医疗机构优先使用本次集中带量采购中选产品,并确保完成协议采购量;超出协议采购量的部分,中选企业仍需按中选价格进行供应,直至采购周期届满。采购周期内如遇国家政策调整,按相关规定执行。
Copyright © 2011-2012 350浦京首页集团 All Rights Reserved. 粤ICP备2022155250号-1
电
话:0755-82497618 传 真:0755-82497861