中国食品药品网讯 国家市场监督管理总局公布《药品经营和使用质量监督管理办法》;国家药监局、国家卫生健康委发布实施《中华人民共和国药典》(2020年版)第一增补本;国家医保局公布第二、三批国家组织药品集中采购中选仿制药临床疗效和安全性真实世界研究结果……10月11日—10月17日,医药行业的这些动态值得关注。
行业政策动态
1.国家市场监督管理总局公布《药品经营和使用质量监督管理办法》(以下简称《办法》),自2024年1月1日起施行。在完善药品经营许可管理方面,《办法》明确药品批发企业、零售连锁总部、零售企业的许可条件和申请材料要求,简化药品经营许可审批程序,优化药品批发企业开办标准,并明确药品批发企业、零售企业经营范围核定标准,对申请仅从事乙类非处方药零售活动的,申请人提交申请材料和承诺书后,符合条件的,当日颁发药品经营许可证。在夯实经营活动中各相关方责任方面,《办法》强化药品上市许可持有人、药品经营企业的质量管理责任,细化其对药品购销人员、购销行为、储存运输等的管理要求,强调药品上市许可持有人、药品经营企业委托储存、运输活动的质量管理要求,并对药品零售连锁提出总部对所属门店统一管理的要求。在加强药品使用环节质量管理方面,《办法》对医疗机构药品的质量管理部门和人员、储存和养护、药品质量问题处理和召回、药品追溯等作出规定。要求医疗机构和其他药品使用单位建立药品质量管理体系,对本单位药品购进、储存、使用全过程的药品质量管理负责。在强化药品经营和使用全过程全环节监管方面,《办法》进一步明确国家、省、市县各层级药品监管部门的职责划分,明晰跨区域监管责任,丰富行政处理措施,明确行刑纪衔接等要求,确保监管责任全面落实。此外,还规定药品监管部门对医疗机构进行处罚,应通报卫生健康主管部门。
2.国家药监局、国家卫生健康委联合发布《中华人民共和国药典》(2020年版)第一增补本,自2024年3月12日起施行。目录显示,该增补本涉及品种693个。其中新增品种47个,包括一部的儿童清咽解热口服液、双金连合剂等,二部的注射用三氧化二砷、枸橼酸西地那非、糠酸莫米松乳膏等,四部的水杨酸甲酯、玻璃酸钠、结冷胶等。修订品种646个,一部、二部、三部、四部均有,其中二部的多达461个,包括乙胺利福异烟片、水杨酸、甲硝唑片、吡拉西坦口服溶液、阿卡波糖片、缬沙坦等。
3.国家药监局发布《关于化学原料药再注册管理等有关事项的公告》,进一步明确化学原料药批准通知书发放、再注册、注销批准证明文件等有关事宜,并给予一定再注册过渡期。该公告指出,化学原料药按照药品管理,其登记注册、补充申请及再注册申请属于行政许可事项,药监部门按照有关规定开展审评审批。境内生产化学原料药登记人应为化学原料药实际生产企业,境外生产化学原料药登记人应委托中国境内的企业法人进行登记。
4.国家药监局发布《关于无参比制剂品种仿制研究的公告》,明确无参比制剂品种仿制申报路径和相关技术要求。按照公告,对于无参比制剂品种,经评估如有预期临床价值,申请人可开展仿制研究,参照现行仿制药注册分类提出上市申请。公告要求,所仿制的品种应符合当前科学认识和临床诊疗需求及实践,作为主流药品被广泛使用,且具备不可替代性特征,同时有足够临床试验数据支持临床获益大于风险。申请人应充分评估拟申报品种的预期临床价值,并通过良好设计的临床试验证明其预期临床价值。申请人应基于现行技术要求开展仿制研究,并对已上市同品种药品开展全面质量评估。仿制药品质量不低于研究充分、上市基础好或在相应治疗领域市场份额较大的已上市品种。
5.国家医保局召开新闻发布会,公布了第二、三批国家组织药品集中采购中选仿制药临床疗效和安全性真实世界研究结果。结果显示,此次研究选取的23个具有代表性集采中选仿制药,与原研药在临床疗效与安全性上相当。
6.国家卫生健康委发布《2022年我国卫生健康事业发展统计公报》。公报显示,2022年全国卫生总费用初步推算为84846.7亿元,其中,政府卫生支出23916.4亿元,占28.2%;社会卫生支出38015.8亿元,占44.8%;个人卫生支出22914.5亿元,占27.0%。人均卫生总费用6010.0元,卫生总费用占GDP的比例为7.0%。2022年,全国医疗卫生机构总诊疗人次84.2亿,与上年基本持平。全国中医类医疗卫生机构总数80319个,比上年增加2983个,总诊疗人次12.3亿,比上年增加0.2亿人次。
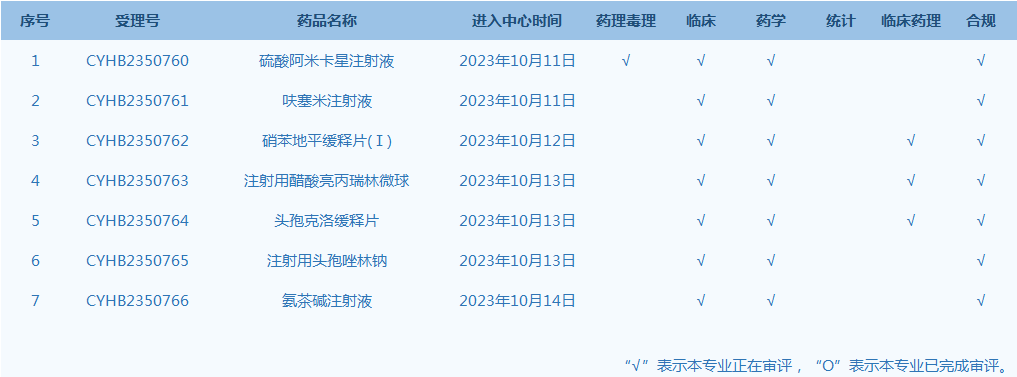
7.国家药监局药品审评中心(CDE)网站公示7个仿制药一致性评价任务,涉及硫酸阿米卡星注射液等品种。(截至10月17日)
产品研发上市信息
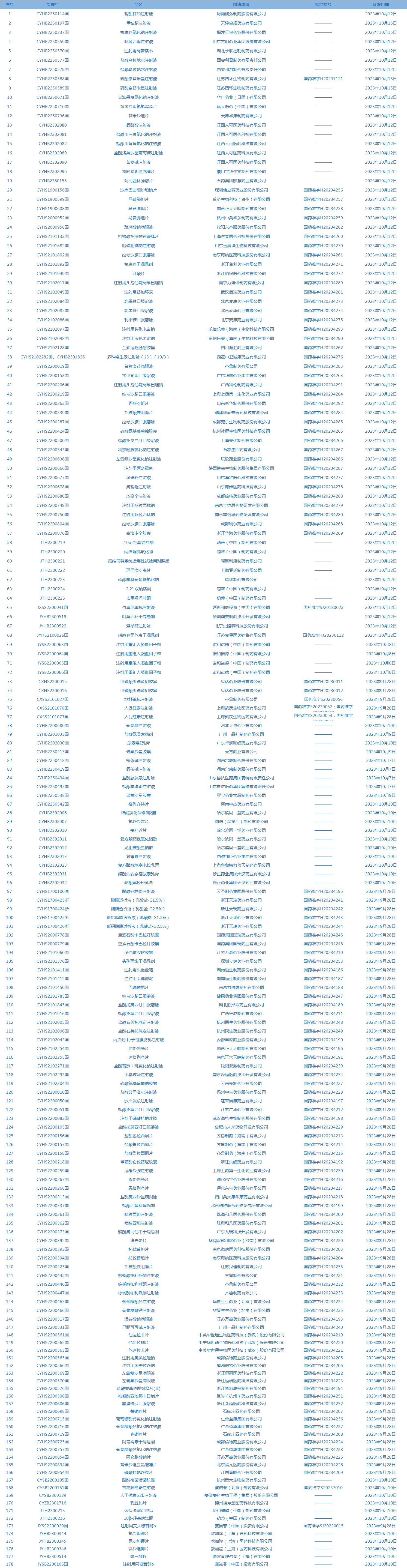
1.国家药监局发布两期药品批准证明文件送达信息,共包括178个受理号,涉及远大医药(中国)有限公司等企业。(截至10月17日,详见图2)
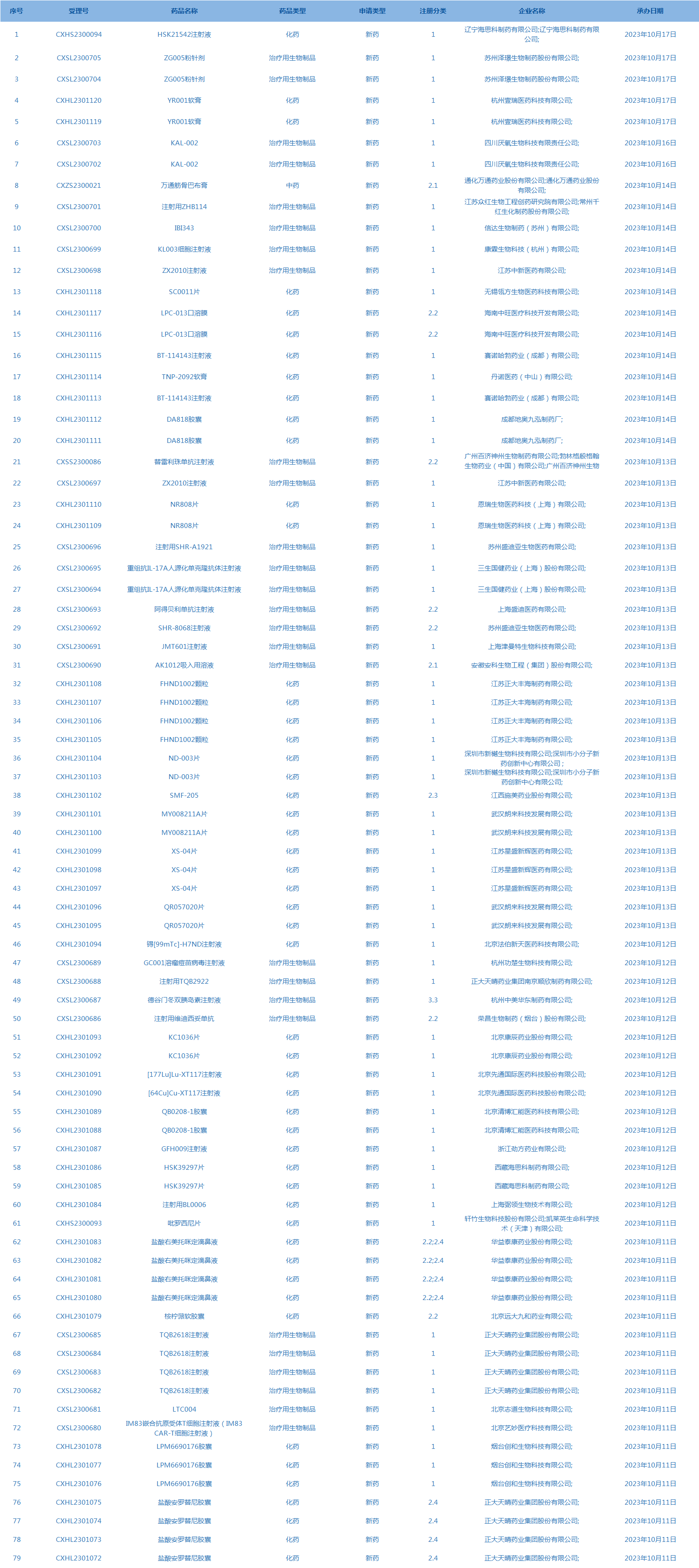
2.CDE承办受理79个新药上市申请,包括HSK21542注射液等药品。(截至10月17日,详见图3)
3.普利制药发布公告称,公司全资子公司浙江普利药业有限公司于近日收到了美国食品药品管理局(FDA)签发的注射用PL002创新药临床试验申请(IND)的受理通知。
4.劲方医药宣布,公司产品SLS009获得美国FDA孤儿药资格认定,用于治疗急性髓系白血病(AML)患者。
5.辉大基因宣布,RNA编辑疗法HG204获得美国FDA授予的儿科罕见病资格认定(RPDD),用于治疗一种罕见且致命的儿童神经发育障碍疾病——甲基化CpG结合蛋白-2(MeCP2)重复综合征(MDS)。
医药企业观察
1.恒瑞医药宣布将其自主研发的PD-1抑制剂卡瑞利珠单抗与阿帕替尼联合用于治疗肝细胞癌,在除大中华区和韩国以外全球范围内开发及商业化的独家权利有偿许可给Elevar Therapeutics公司。根据协议条款,基于卡瑞利珠单抗在美国、日本和约定的欧洲国家分别首次获批上市及实际年净销售额情况,Elevar Therapeutics将在达到一定累计净销售额后向恒瑞支付累计6亿美元的销售里程碑款,并在超过一定累计净销售额后额外付款,另有实际年净销售额20.5%的销售提成。
2.凡恩世生物宣布与默沙东达成临床合作协议,以研究凡恩世生物的Claudin18.2/CD47双特异性抗体PT886与默沙东的PD-1抑制剂帕博利珠单抗在接受或不接受化疗的Claudin18.2阳性的胃癌或胃食管交界处癌(GEJ)患者中的联合用药。
3.亚盛医药宣布与阿斯利康达成临床合作协议,双方将共同进行Bcl-2抑制剂APG-2575联合阿斯利康的布鲁顿酪氨酸激酶(BTK)抑制剂康可期(通用名:阿可替尼)的注册性Ⅲ期临床研究,用于初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者一线治疗。
4.赛托生物拟通过支付现金方式收购银谷制药有限责任公司60%股份,交易价格为人民币4.58亿元。交易完成后,公司将成为银谷制药的控股股东。
5.莎普爱思发布公告称,公司与恒道医药签署了《技术转让(技术秘密)合同》,恒道医药将其拥有的盐酸毛果芸香碱滴眼液药物临床试验批件项目的技术秘密、所有权(包括但不限于生产、销售等权利)转让予公司。
6.誉衡药业拟受让哈尔滨瀚钧投资有限公司持有的哈尔滨蒲公英药业有限公司10%股权,受让价格为人民币3500万元。本次股权受让完成后,公司将持有蒲公英药业85%股权。
7.新元素医药宣布完成超6亿元人民币的D轮融资。本轮融资由凯泰资本领投,达晨财智、华金投资、乾道集团等跟投。本轮融资完成后,该公司总融资金额达约12亿元人民币。此次D轮融资资金将主要用于完成ABP-671在全球的关键性临床研究,以及进一步推进治疗炎症和其他疾病的创新药物管线的研发。
药品集中采购
1.上海阳光医药采购网发布《全国药品集中采购文件(GY-YD2023-2)》,第九批集采将于11月6日在上海进行价格申报、开标,共有42个药品品种被纳入集采。其中,共有20种药品为注射剂,占比约50%。此外,与今年8月公布的报量目录对比发现,艾司洛尔注射剂型与右丙亚胺(右雷佐生)注射剂未出现在正式集采目录中。
2.福建省药械联合采购中心就《福建省第四批药品集中带量采购文件(化学药品类,征求意见稿)》《福建省第四批药品集中带量采购文件(中成药类,征求意见稿)》公开征求意见。化学药有50个品种,中成药有24组共44个品种纳入此次集采。
3.江苏省医保局发布《江苏省第四轮药品集中带量采购公告(一)》,江苏省将开展第四轮药品集中带量采购,采购品种为江苏省平台已挂网、但从未纳入国家集采中筛选出的部分品种,包括西药40个、中成药17组品种。




